La maladie cutanée chronique du greffon contre l’hôte bouleverse la vie de nombreux patients après une greffe de cellules souches. Douleurs, démangeaisons, peau qui se durcit, mobilité qui diminue… pendant longtemps, les outils d’évaluation ont eu du mal à refléter ce que les personnes ressentaient vraiment au quotidien. Un nouveau cadre d’évaluation, porté par un groupe international d’experts et soutenu par les travaux du NIH, change aujourd’hui la donne en plaçant enfin au centre la réalité vécue par les patients et leurs proches.
Ce nouveau référentiel ne se contente plus de mesurer la surface de peau atteinte. Il s’intéresse à la qualité des tissus, à la souplesse, à la douleur, à l’impact sur les gestes simples comme s’habiller, se doucher, marcher. Il intègre aussi des perspectives d’avenir très concrètes : biomarqueurs, outils de mesure high-tech non invasifs, stratégies personnalisées. Pour les patients, les familles et les soignants, cela ouvre la voie à des décisions thérapeutiques plus fines, plus justes, et surtout plus humaines. 💛
| Peu de temps ? Voilà ce qu’il faut retenir : |
|---|
| ✅ Un nouveau cadre d’évaluation de la maladie cutanée chronique du greffon contre l’hôte permet de mieux mesurer les vraies améliorations vécues par les patients. |
| ✅ Les symptômes de type éruption et les atteintes sclérosantes sont désormais notés séparément, ce qui affine les décisions de traitement. 🔍 |
| ✅ De nouveaux outils (échelles cliniques détaillées, biomarqueurs, mesures de rigidité cutanée) préparent une prise en charge plus personnalisée et mieux anticipée. |
| ✅ Impliquer le patient dans l’évaluation, comme on le fait déjà pour le suivi des traitements antalgiques ou le bon dosage des médicaments chroniques, devient une étape clé du parcours de soins. 💬 |
Comprendre la maladie cutanée chronique du greffon contre l’hôte : une complication fréquente mais longtemps mal mesurée
Après une greffe de cellules souches, la priorité est souvent la rémission de la maladie initiale, en particulier les cancers du sang. Pourtant, une autre réalité s’impose très vite : la maladie chronique du greffon contre l’hôte, et en particulier sa forme cutanée. Dans cette situation, les cellules immunitaires du donneur attaquent la peau du receveur, comme si cette dernière était étrangère. Ce phénomène touche environ la moitié des patients, parfois de façon légère, parfois de manière sévère et très handicapante.
Concrètement, les symptômes cutanés peuvent prendre plusieurs visages. D’abord, des éruptions rouges, douloureuses ou prurigineuses, avec une sensation de brûlure ou de tiraillement permanente. Progressivement, chez certains, les tissus se durcissent en profondeur : la peau devient épaisse, rigide, peu extensible. Ce durcissement, qu’on appelle sclérose, peut gêner la flexion des doigts, limiter l’élévation des bras, voire rendre difficiles des gestes essentiels comme se coiffer ou mettre ses chaussures. Cette atteinte cutanée ne reste jamais « seulement » esthétique : elle touche directement la mobilité, l’autonomie et l’image de soi.
Dans les années 2010, des premiers critères internationaux ont été posés pour décrire et classer cette maladie. Ils ont permis de parler un langage commun entre centres de greffe, d’inclure des patients dans des études et de tester des traitements. Cependant, ces anciens critères reposaient très fortement sur des estimations de surface corporelle atteinte. Résultat : un patient pouvait sentir sa peau beaucoup plus souple, lever à nouveau les bras ou marcher plus facilement, mais si la zone globale restait à peu près la même, le traitement n’était pas officiellement considéré comme un « succès » dans les essais. ❌
Imagine une personne comme Malik, 42 ans, ayant reçu une greffe pour une leucémie. Sa peau du tronc et des cuisses est très dure, l’empêchant de se pencher ou de faire ses étirements. Après plusieurs mois d’un nouveau traitement, la surface atteinte ne change quasiment pas, mais la peau gagne nettement en élasticité : il peut enfin s’habiller seul et conduire à nouveau. Pour lui, c’est une victoire évidente. Pourtant, avec l’ancien cadre d’évaluation, cette amélioration passait presque au second plan.
Cette discordance entre les chiffres et le vécu a longtemps pesé sur les décisions thérapeutiques. Certains protocoles étaient jugés peu efficaces, alors qu’ils apportaient une vraie amélioration fonctionnelle. Des patients, de leur côté, se sentaient parfois incompris : « Sur le papier, rien n’a changé, mais dans la vie de tous les jours, ça va mieux. » C’est cette fracture entre la science et le quotidien qui a poussé un groupe de travail international à revoir en profondeur la façon de mesurer la maladie cutanée chronique du greffon contre l’hôte.
Ce besoin de mieux coller à la réalité du terrain n’est pas propre à cette pathologie. On le retrouve dans d’autres domaines, comme l’évaluation du risque d’ostéoporose après certaines prises de sang prolongées, largement détaillée sur une analyse dédiée aux fragilités osseuses, ou encore dans le suivi des maladies auto-immunes où l’on ne se contente plus d’un seul examen pour décider d’un parcours de soins. L’enjeu reste le même : mesurer ce qui compte vraiment pour le patient, pas seulement ce qui est facile à quantifier.
En toile de fond, ce changement d’approche annonce déjà la prochaine étape : intégrer systématiquement la fonction, la qualité de vie et les marqueurs biologiques dans les décisions. La peau n’est plus un simple « organe cible » à cocher dans un tableau, mais un miroir de la santé globale et de la capacité à vivre normalement.
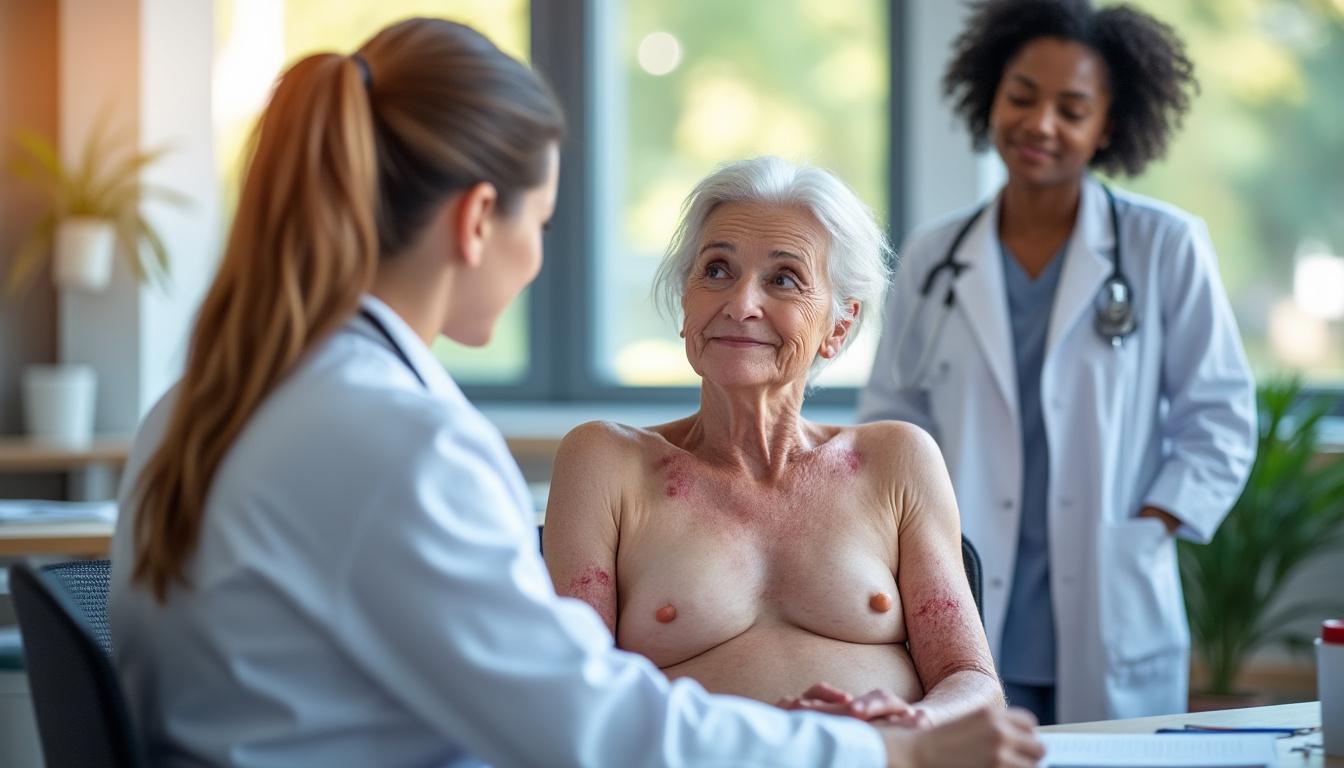
Un cadre innovant centré sur la peau : éruptions, sclérose et fonctions quotidiennes
Le nouveau cadre d’évaluation porté par le projet de consensus des NIH propose une véritable révolution silencieuse : au lieu de fusionner tous les signes cutanés dans une seule note globale, il distingue clairement deux grands types d’atteintes. D’un côté, les symptômes de type éruption (épidermiques), de l’autre, les atteintes sclérosantes (plus profondes). Cette séparation peut sembler technique, mais elle change tout pour comprendre la réponse au traitement. 🎯
Les éruptions cutanées évoluent souvent rapidement : elles peuvent s’améliorer en quelques semaines avec un traitement bien ciblé. À l’inverse, la sclérose est un phénomène beaucoup plus lent, souvent lié à une fibrose progressive des tissus. La nouvelle grille prévoit donc des rubriques de notation distinctes pour ces deux réalités. Ainsi, un médicament qui réduit très bien l’inflammation mais peu la sclérose ne sera plus jugé « globalement moyen » : il sera reconnu pour sa force principale, ce qui aidera à mieux combiner les thérapies.
Ce cadre intègre également de nouvelles échelles cliniques, remises à plat. Les soignants ne se contentent plus de décrire la zone touchée : ils évaluent la qualité de la peau (douceur, fermeté, épaisseur), la possibilité de pincer un pli cutané, la mobilité des articulations sous-jacentes, mais aussi l’impact sur la vie quotidienne. Peut-on enfiler un tee-shirt sans douleur ? Faire un shampoing sans bloquer les épaules ? Ouvrir un bocal sans gêne au niveau des doigts ? Ces questions deviennent des marqueurs à part entière, au même titre qu’un chiffre sur une échelle.
Pour les soignants, ce changement demande de nouveaux réflexes, proches de ceux qu’ils ont adoptés dans d’autres spécialités. Par exemple, en rhumatologie ou dans le suivi des myalgies, où des techniques comme l’aiguilletage pour les douleurs musculaires imposent d’évaluer précisément la douleur, l’amplitude et la force avant et après traitement. Dans la maladie cutanée chronique du greffon contre l’hôte, la même exigence se met en place : objectiver ce qui est ressenti, pour décider de manière plus fine.
Un aspect clé de ce nouveau cadre est également la notion de seuils de réponse plus sensibles. Les anciennes recommandations exigeaient parfois des variations très importantes de surface atteinte pour considérer qu’un traitement « fonctionnait ». Désormais, des améliorations plus modestes mais cliniquement très parlantes, comme une souplesse gagnée ou une réduction partielle de l’œdème, pèsent davantage dans la balance. Le but n’est plus d’avoir des chiffres spectaculaires, mais de repérer les progrès qui changent la journée d’un patient.
Pour illustrer cette approche, prenons l’exemple de Claire, 55 ans, dont les avant-bras étaient très sclérosés. Elle ne pouvait plus tourner la clé de sa porte sans douleur. Après six mois sous un traitement ciblé, la zone atteinte n’a pratiquement pas diminué en superficie, mais la peau est devenue nettement plus souple. Elle réutilise ses poignets, peut jardiner à nouveau. Dans le nouveau cadre, cette progression serait reconnue comme une réponse clinique significative, ce qui encouragerait à poursuivre ou ajuster la thérapie plutôt qu’à l’abandonner trop vite.
Ce changement de regard s’inscrit dans une tendance plus large de la médecine contemporaine : baser les décisions à la fois sur des données objectives et sur l’expérience du patient. On le voit dans le suivi du microbiome intestinal pour certaines pathologies, comme présenté dans les travaux sur des outils innovants d’analyse du microbiote. Pour la maladie cutanée chronique du greffon contre l’hôte, la peau devient, elle aussi, une « interface » qu’on écoute avec autant de précision que l’on mesure.
En rendant les critères plus sensibles et plus nuancés, ce nouveau cadre ouvre une porte essentielle : celle des traitements sur mesure, adaptés au profil cutané et fonctionnel de chaque personne, plutôt qu’à une moyenne statistique déconnectée du vécu.
Biomarqueurs et outils de mesure high-tech : vers une évaluation plus précise et prédictive de la cGVHD cutanée
Au-delà des grilles cliniques, le groupe de travail international met en avant une piste stratégique : développer des biomarqueurs capables de signaler très tôt une forme sévère de maladie cutanée du greffon contre l’hôte. L’idée est simple à formuler, mais puissante : disposer d’indices biologiques, dans le sang ou la peau, qui alertent avant que les symptômes ne soient trop avancés. Un peu comme un détecteur de fumée qui sonne avant que le feu ne prenne toute la maison. 🔔
Dans cette perspective, des cliniciens-chercheurs plaident pour augmenter la collecte de marqueurs de fibrose, d’inflammation et de signaux immunologiques, notamment au niveau des lymphocytes T. Beaucoup de ces marqueurs ont déjà été repérés dans la recherche, mais ils ne sont pas encore intégrés aux pratiques de routine. Organiser des prélèvements de sang réguliers, voire des échantillons cutanés mini-invasifs, permettrait de repérer un profil à haut risque et d’ajuster le traitement beaucoup plus tôt.
Parmi les techniques évoquées, une méthode attire particulièrement l’attention : le décapage par bande cutanée. Elle consiste à prélever des couches superficielles de la peau à l’aide de bandes adhésives spécifiques. Ce geste, bien moins agressif qu’une biopsie classique, offre suffisamment de matériel pour analyser certaines protéines et cellules clés. Pour les patients, cela signifie potentiellement moins de cicatrices, moins de douleurs, et des contrôles plus fréquents donc plus utiles.
À côté de ces approches biologiques, des outils technologiques sont en pleine évaluation. La myotonométrie, par exemple, permet de mesurer la rigidité des tissus de manière objective, en appliquant un léger stimulus mécanique et en analysant la réponse. Les ultrasons à haute fréquence, eux, offrent une imagerie détaillée des couches de la peau, ce qui aide à voir si la sclérose s’enfonce ou au contraire régresse. Même si ces technologies ne sont pas encore intégrées officiellement au nouveau cadre, elles se dessinent comme de futurs compléments très prometteurs.
Cette volonté de croiser clinique, biologie et technologie rappelle d’autres innovations médicales, comme l’essor du suivi glycémique sans piqûre par spectroscopie Raman. Dans le diabète comme dans la maladie du greffon contre l’hôte, l’objectif reste d’alléger la charge des examens sans perdre en précision, voire en gagnant une longueur d’avance sur la maladie.
Concrètement, que pourrait changer un biomarqueur prédictif pour un patient ? Imaginons Léa, jeune adulte greffée, dont la peau semble encore peu atteinte. Une prise de sang révèle un profil de cytokines et de lymphocytes T associé à un risque élevé de forme sclérosante sévère. Au lieu d’attendre que la peau se durcisse, l’équipe décide de renforcer rapidement l’immunosuppression ciblée, de surveiller étroitement la souplesse cutanée et de mettre en place des exercices de mobilité quotidienne. Ainsi, la maladie est prise de vitesse, et les chances de conserver une bonne fonction motrice augmentent nettement.
Pour les équipes de recherche, le développement de ces biomarqueurs implique une organisation spécifique : biobanques de sang et de peau, collaboration entre centres, partage de données anonymisées. Ce mouvement collectif n’est pas sans rappeler certaines grandes études multicentriques, qu’on retrouve également dans des pathologies auto-immunes complexes, comme le lupus, où des approches intégrées de type thérapies innovantes combinées ont changé le pronostic de nombreux patients.
En toile de fond, une conviction se renforce : la médecine de demain ne pourra plus se contenter de l’œil nu. Pour la maladie cutanée chronique du greffon contre l’hôte, la combinaison de grilles cliniques affinées et de biomarqueurs bien choisis pourrait transformer une pathologie imprévisible en maladie beaucoup plus contrôlable et anticipée.
Impact concret pour les patients : qualité de vie, gestes du quotidien et suivi personnalisé
Si ce nouveau cadre d’évaluation est si important, c’est avant tout parce qu’il s’intéresse à ce qui compte le plus pour les patients : retrouver une vie la plus normale possible. Sur le papier, cela se traduit par de nouvelles échelles fonctionnelles, mais dans la réalité, ce sont surtout des petits gestes qui reviennent : lever les bras sans douleur, serrer la main d’un proche, prendre une douche sans craindre que l’eau brûle les plaques rouges. 🌿
Les échelles cliniques révisées accordent désormais une place centrale à la fonction. Les questions posées par les soignants évoluent : plutôt que « Quelle surface de peau est atteinte ? », on entend davantage « Qu’est-ce que cela vous empêche de faire ? », « Le matin, l’habillage prend-il plus de temps qu’avant ? », « Avez-vous besoin d’aide pour monter les escaliers ? ». Ces éléments, auparavant considérés comme anecdotiques, deviennent des indicateurs majeurs pour juger de l’efficacité d’un traitement.
Cette approche se rapproche des bonnes pratiques déjà bien installées dans d’autres domaines, comme l’évaluation des effets indésirables de certains compléments alimentaires ou médicaments. L’analyse des risques liés à des produits courants, par exemple dans les mises en garde sur le Morosil et ses potentielles complications, repose elle aussi sur l’écoute des symptômes concrets des patients et pas seulement sur les chiffres des essais cliniques.
Au quotidien, ce nouveau regard modifie aussi la manière d’organiser les consultations. Plutôt que de courir après le temps pour remplir un formulaire standardisé, les équipes apprennent à structurer l’entretien autour de quelques axes clés :
- 🧴 Confort cutané : démangeaisons, douleurs, sensations de brûlure, besoin de gratter ou d’appliquer souvent des crèmes.
- 🧍 Mobilité et autonomie : capacité à se laver, s’habiller, cuisiner, travailler, porter des charges légères.
- 🧠 Ressenti psychologique : image de soi, gêne sociale liée aux lésions visibles, fatigue morale.
- 📅 Évolution dans le temps : ce qui s’est amélioré, ce qui reste bloqué, ce qui inquiète le plus pour les semaines à venir.
Ces dimensions sont ensuite croisées avec les données objectives : photos standardisées, mesures de souplesse cutanée, résultats biologiques. L’objectif est de construire un véritable « tableau de bord » personnalisé, qui permettra de juger non seulement si la maladie s’apaise, mais si la personne reprend le contrôle de sa vie.
Des parallèles intéressants peuvent être faits avec d’autres suivis prolongés, comme ceux liés aux traitements métaboliques ou hormonaux. Dans la surveillance des effets de certains médicaments sur le poids ou le métabolisme, les équipes s’intéressent autant aux chiffres qu’aux sensations, comme le montrent les analyses d’admissibilité aux traitements GLP-1 ou le bilan global du système urinaire masculin. Pour la cGVHD cutanée, la même logique se met en place : la personne devient partenaire actif de son suivi, et pas simple « receveur de soins ».
Pour les patients et leurs proches, une attitude simple peut déjà faire une vraie différence : noter, semaine après semaine, quelques repères concrets. Par exemple :
- 📓 Noter la facilité ou non à enfiler un vêtement serré.
- 🖐️ Observer si l’on peut ramasser un objet au sol sans blocage douloureux.
- 🛁 Évaluer le confort lors de la douche (eau supportée, zones hyper sensibles).
- 💼 Vérifier si les tâches du travail ou de la maison deviennent plus simples ou plus pénibles.
Apporter ces observations en consultation aide vraiment les soignants à affiner leur jugement, à adapter les doses de traitement (comme on le ferait dans un ajustement de médicament au long cours) et à orienter vers des rééducations ciblées.
Ce cadre innovant rappelle une chose essentielle : dans la maladie cutanée chronique du greffon contre l’hôte, l’important n’est pas seulement ce qui se voit, mais ce qui se vit. La qualité de vie devient un critère thérapeutique à part entière, au même titre que la biologie ou l’imagerie.
Ce que ce nouveau cadre change pour les soignants, les essais cliniques et l’organisation des soins
Pour les professionnels de santé, l’arrivée de ce référentiel ne se limite pas à remplir une nouvelle grille. C’est un changement de culture. Les médecins, infirmiers, kinés, dermatologues et hématologues sont amenés à parler un langage commun plus riche, où chaque détail compte : type de lésions, profondeur, fonction, évolution dans le temps. Ce vocabulaire partagé permet de mieux coordonner les prises en charge, d’éviter les malentendus et de gagner en réactivité.
Dans les essais cliniques, les conséquences sont tout aussi importantes. Les critères de succès deviennent plus réalistes et plus alignés sur ce que les patients attendent réellement. Un traitement qui améliore nettement la mobilité, même sans réduire de façon spectaculaire la surface de peau atteinte, pourra désormais être reconnu et valorisé. 🎓
Pour illustrer ce basculement, le tableau suivant résume les différences entre l’ancien et le nouveau cadre :
| Aspect clé 🧩 | Ancien cadre d’évaluation | Nouveau cadre innovant |
|---|---|---|
| Type de lésions | Regroupement des symptômes cutanés dans une seule catégorie. | Séparation claire entre éruptions et sclérose pour mieux suivre chaque profil. ✅ |
| Critère principal | Surface corporelle atteinte, avec seuils élevés de variation. | Prise en compte de la qualité de la peau, de la souplesse et de l’impact sur la fonction. 💪 |
| Place du patient | Rôle surtout passif, centré sur l’observation clinique. | Participation active via le récit des difficultés quotidiennes et des progrès ressentis. 🗣️ |
| Outils futurs | Peu d’intégration des biomarqueurs et technologies avancées. | Ouverture vers biomarqueurs, myotonométrie, ultrasons haute fréquence pour plus de précision. 🔬 |
Pour les équipes, ce nouveau cadre implique aussi d’adapter la formation. Les jeunes soignants apprennent à examiner la peau autrement, à tester la mobilité en douceur, à utiliser des outils de mesure standardisés. Les plus expérimentés complètent leurs habitudes par ces nouvelles échelles, un peu comme lorsqu’ils ont intégré progressivement les recommandations actualisées dans l’utilisation de certains anti-inflammatoires, à l’image des mises en garde autour du kétoprofène et de ses erreurs d’usage.
Le suivi coordonné devient alors essentiel. Dans la pratique, cela peut se traduire par :
- 🤝 Des consultations pluridisciplinaires regroupant hématologue, dermatologue et rééducateur.
- 📷 L’utilisation régulière de photos standardisées pour suivre l’évolution des lésions.
- 📈 L’intégration de scores fonctionnels simples dans le dossier, remplis à chaque visite.
- 🧪 La planification progressive de prélèvements pour intégrer, à terme, des biomarqueurs pertinents.
Dans les centres de greffe, la mise en commun des données issues de ce nouveau cadre d’évaluation permettra de comparer plus facilement les résultats entre établissements, de repérer les pratiques qui fonctionnent le mieux et de les diffuser rapidement. Pour les industriels développant de nouveaux médicaments, cela donnera aussi des repères plus concrets pour concevoir des thérapies ciblées, en phase avec les besoins réels des patients.
Au final, ce changement d’échelle et de regard offre une opportunité : transformer une maladie redoutée et complexe en une pathologie mieux comprise, mieux suivie et mieux discutée en équipe avec le patient au centre.
Comment les patients et les proches peuvent s’approprier ce nouveau cadre d’évaluation
Reste une question essentielle : comment, dans la vraie vie, patients et aidants peuvent-ils tirer parti de ce cadre innovant ? La réponse tient souvent à de petites habitudes à prendre, qui facilitent le dialogue avec les soignants et rendent l’évaluation plus fidèle à la réalité. 📌
La première étape concrète est de préparer la consultation. Noter en amont les symptômes les plus gênants, les changements observés depuis la dernière visite, les gestes qui posent problème au quotidien. Cela peut se faire dans un simple carnet ou sur une note de téléphone. L’important est de garder une trace régulière, car la mémoire peut parfois lisser les fluctuations, surtout dans une maladie chronique où les jours « avec » et « sans » se succèdent.
Une deuxième habitude utile consiste à utiliser un langage simple mais précis. Par exemple, au lieu de dire « ça va un peu mieux », préciser : « J’arrive à lever le bras au-dessus de la tête alors que ce n’était pas possible il y a deux mois », ou « je peux marcher jusqu’au métro sans avoir la sensation de peau qui tire ». Ce type de détail aide les médecins à mieux remplir leurs nouvelles grilles et à objectiver les progrès.
Pour les proches, le rôle d’observateur bienveillant est précieux. Ils peuvent remarquer que la personne bouge plus facilement, qu’elle met moins de temps à s’habiller, ou qu’elle évite moins certains gestes. Partager ces éléments en consultation, avec l’accord du patient, peut compléter ce que ce dernier n’ose pas toujours dire, par pudeur ou par peur de « déranger ».
Il peut aussi être utile de s’informer, à un rythme raisonnable, sur les innovations en cours : biomarqueurs, technologies de mesure, essais cliniques. Sans chercher à devenir spécialiste, comprendre les grandes lignes permet de poser les bonnes questions : « Est-ce que, dans mon cas, un suivi biologique plus poussé serait utile ? », « Existe-t-il des études cliniques adaptées à mon profil ? ». De la même façon qu’on se renseigne sur les nouvelles stratégies thérapeutiques dans d’autres maladies chroniques, ce type de curiosité peut devenir un vrai levier d’empowerment.
Une vigilance importante reste toutefois de mise : éviter les promesses trop belles ou les solutions miracles, notamment en ligne. Tout comme pour certains compléments supposés « booster » la santé mais dont les risques sont mal connus, la prudence recommandée dans des analyses comme celles dédiées aux dangers potentiels de certains compléments s’applique aussi ici : valider chaque information avec l’équipe de soins reste la règle d’or.
En pratique, une action simple peut être mise en place dès maintenant : choisir un ou deux indicateurs personnels de bien-être cutané et fonctionnel (par exemple « habillage sans aide » et « marche sans douleur ») et les noter chaque semaine. Ces repères, partagés régulièrement avec l’équipe, s’inscrivent parfaitement dans l’esprit du nouveau cadre : faire du patient un partenaire actif, et non un spectateur de sa maladie.
Ce nouveau regard sur la maladie cutanée chronique du greffon contre l’hôte rappelle enfin une vérité discrète mais essentielle : derrière chaque score, chaque critère, chaque biomarqueur, il y a une personne qui cherche simplement à retrouver des gestes simples et une vie plus légère. Garder cela en tête, côté patients comme côté soignants, reste sans doute le meilleur guide pour avancer ensemble. 💬
La maladie cutanée chronique du greffon contre l’hôte peut-elle disparaître complètement ?
Dans certains cas, les symptômes cutanés peuvent s’atténuer fortement avec le temps et les traitements, jusqu’à devenir très discrets. Cependant, la maladie garde souvent un caractère chronique, avec des périodes plus calmes et des phases de reprise. L’objectif du nouveau cadre d’évaluation est justement d’identifier plus tôt les formes sévères et de mieux ajuster les thérapies pour limiter au maximum les séquelles et préserver la fonction.
À quoi sert concrètement le nouveau cadre d’évaluation pour un patient ?
Ce référentiel permet de mieux décrire la réalité de la peau (éruptions, sclérose, douleur, souplesse) et de relier ces éléments à la vie quotidienne : habillage, marche, autonomie. Il aide les équipes à décider plus finement si un traitement doit être poursuivi, ajusté ou remplacé, en se basant sur des améliorations réellement ressenties et pas seulement sur la surface de peau atteinte.
Les biomarqueurs sont-ils déjà utilisés en routine pour la cGVHD cutanée ?
Pour l’instant, la plupart des biomarqueurs restent utilisés dans le cadre de la recherche, notamment dans des centres spécialisés. Ils servent à mieux comprendre les mécanismes de la maladie et à tester leur valeur prédictive. L’objectif, à moyen terme, est de les intégrer progressivement dans la pratique courante, par exemple via des prises de sang ou des prélèvements cutanés mini-invasifs, afin d’anticiper les formes sévères et personnaliser les traitements.
Comment un proche peut-il aider au suivi de la maladie cutanée du greffon contre l’hôte ?
Un proche peut soutenir en observant les changements du quotidien (gestes plus faciles, douleurs moins fréquentes), en aidant à noter ces éléments entre les consultations et en accompagnant le patient lors des rendez-vous, s’il le souhaite. Partager un regard extérieur, bienveillant, complète souvent utilement ce que le patient ressent, et facilite l’utilisation des nouveaux outils d’évaluation par l’équipe médicale.
Que faire si l’on a l’impression que les examens ne reflètent pas ce que l’on vit ?
Il est important d’en parler directement avec l’équipe de soins. Expliquer avec des exemples concrets ce qui a changé (en bien ou en mal) aide les professionnels à réajuster leur évaluation. Le nouveau cadre d’évaluation de la cGVHD cutanée est justement conçu pour mieux intégrer ce ressenti. Préparer quelques notes à l’avance, voire un petit journal de bord des symptômes et des gestes du quotidien, peut vraiment améliorer la qualité de l’échange en consultation.

